Aktywne Wpisy

badreligion66 +400

źródło: temp_file302753039126793122
Pobierz
mirko_anonim +64
✨️ Obserwuj #mirkoanonim
Usunąłem tu konto, więc nie wrzucę znaleziska, ale dla tematów demograficznych poświęcam się i wrzucam z anonima. Zanosi się, że na 2024 Polska będzie miała najgorszą dzietność w Europie. Obecnie jest to 1.1 jak widać. Ciekawe kiedy TFR tgeo narodu spadnie poniżej 1.0, może jak dopompujemy deweloperom to się polepszy?
#nieruchomosci #demografia #ekonomia
────────────────
Usunąłem tu konto, więc nie wrzucę znaleziska, ale dla tematów demograficznych poświęcam się i wrzucam z anonima. Zanosi się, że na 2024 Polska będzie miała najgorszą dzietność w Europie. Obecnie jest to 1.1 jak widać. Ciekawe kiedy TFR tgeo narodu spadnie poniżej 1.0, może jak dopompujemy deweloperom to się polepszy?
#nieruchomosci #demografia #ekonomia
────────────────
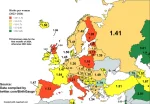
źródło: total-fertility-rate-in-europe-2023-4-data-v0-75tkkqth5kzc1
Pobierz




Mam problem z tym zadaniem, i zanim oskarżę autorów podręcznika o złe odpowiedzi chciałem spytać kogoś innego. O ile na a) wychodzi mi to co w odpowiedziach, czyli 396 sekund, to w b) odpowiedź to 0,285 mol/l. Ale jak robię przyrównanie dwóch wzorów na prędkość reakcji czyli
v = k*[C2H2]*[H2]= dC/dt
to wychodzi mi 5,70 mol/l. Czyli 20 razy za dużo.
Co schrzaniłem? Kinetyki nie dotykałem już bardzo dawno :P
źródło: comment_2B3Oix0xgBgAlzcaMUXJVheQiPZ1Ivrp.jpg
Pobierzźródło: comment_477WFmFiqiw3EP2tilRxMMw3V0bRdo2g.jpg
Pobierz@Przemyslaw_90 I tutaj mamy przykład zle skonstruowanego zadania. Reakcja prowadzona jest w fazie gazowej, nie jest ekwimolarna i brak jest informacji o stałości objętości układu.
@Rammar: jest to prawda, nie pomyślałem o tym zafiksowałem się na kinetycznym podejściu xD ale faktem jest, że nie rozumiem, czemu zastosowany przez mnie wzór nie działa tutaj i wychodzi mi wartość 20 razy za duża. Bo powinienem dostać mimo wszystko dobry wynik... Ale dzięki za