Aktywne Wpisy

Mega_Smieszek +270


toniemojekonto1 +147
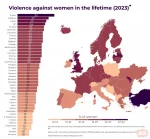
Polscy mężczyźni jak zawsze gorsi od tych na zachodzie ( ͡º ͜ʖ͡º)
#p0lka #europa #statystyka #patologia
#p0lka #europa #statystyka #patologia
Skopiuj link
Skopiuj link



Wykop.pl
dla złota wymyśliłem aby roztopić stop w kwasie azotowym, odsączyć azotany srebra i miedzi od złota i zważyć
macie pomysł jak to ugryźć dalej? może jakoś oddzielić w/w mieszaninę soli i elektrolizować jeden z pierwiastków?
#pytanie #chemia
Jeśli miałbyś zrobić to praktycznie i trudno by było oddzielić pierwszy roztwór od nierozpuszczonego ag bez niszczenia roztworu/utraty objętości, możesz odważyć dwie takie same próbki i tą drugą rozpuścić w HF,
ja bym całość rozkładał w azotowym, złoto by zostało nieroztworzone, a następnie otrzymany roztwór azotanów miedzi i srebra strącił nadmiarem jonów chlorkowych i z masy chlorku srebra (nierozpuszczalnego) wyliczył srebro. pozostałość to już miedź, chyba najprostsze i nie trzeba się babrać z HF
Tutaj rozdział nie musi być konieczny, często metodami elektrolitycznymi (np. polarografia) można oznaczać zarówno ilościowo jak i jakościowo pierwiastki w ich mieszaninach.
Podobnie jak kolega @Bozon_stuleja polecałbym zastosowanie ICP-OES, co pozwoli uniknąć rozdziału mieszaniny azotanów (wykonalne ale pracochłonne).
Jeżeli jednak ktoś jest
@Iperyt: Tak ale konieczna jest obecność utleniacza.
Ja to bym się nie bawił za dużo - rozpuścić próbkę w wodzie królewskiej i zrobić polarografię inwersyjną.