Aktywne Wpisy

pieknylowca +722
Dzień matki u inwestorów #frajerzyzmlm
źródło: IMG_20240526_080453
Pobierz
K_R_S +81
wychodzi na to że nawet uwzględniając kopalnie litu i inne koszty wytwarzania, to i tak auta spalinowe emituja dużo więcej CO2.
Wrzucam bo sam nie wiedziałem. Nie znam odpowiedzi na pytanie 'i co z tego'
#motoryzacja
Wrzucam bo sam nie wiedziałem. Nie znam odpowiedzi na pytanie 'i co z tego'
#motoryzacja
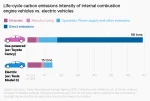
źródło: temp_file6627286092721523086
Pobierz




@Iperyt
Heja,wiem że zielonka ze mnie,ale pomyślałem że może pomożecie,muszę dokończyć sprawko na materiałoznastwo (laby) i nie jestem pewien kilku reakcji i wniosków do nich potrzebnych.
Mamy takie doświadczenie.
Przygotowaliśmy 4 oczyszczone papierem ściernym blaszki żelazne o wymiarach 6x60 mm. Owinęliśmy jedną z blaszkę paskiem blaszki magnezowej, drugą paskiem blaszki miedzianej trzecią blaszką cynową, a czwarta blaszka stała się próbą porównawczą, gdyż została nieowinięta paskiem metalu. Gotowe blaszki umieściliśmy kolejno w czterech zlewkach, następnie do zlewek wlaliśmy 3% roztwór NaCl, tak aby blaszki z paskami metali były zanurzone. Do każdej zlewki dodaliśmy kilka kropli heksażelazicyjanianu(III) potasu.
Jak te reakcje przebiegną?
Pozostaje wygooglowac po co jest heksazelazocyjan.
Czyli te owiniete cyna i miedzia powinny byc mniej wiecej w takim samym stanie jak probka kontrolna. Magnez powinien ochronic probke.
@r4do5: G prawda, na styku żelazo - metal o wyższym potencjale wytworzy się ogniwo i żelazo będzie korodowało szybciej niż kontrolna. Będzie tak (od próbki najbardziej do najmniej skorodowanej): z miedzią, z cyną, kontrolna, z magnezem. Tylko też nie wiem po co ten heksacyjanożelazian. Z drugiej strony to jest zadanie na poziomie liceum, z
@neo_1995: takie mialem podejrzenia, ze przyspiesza reakcje
Edit: Wołam @neo_1995
Metal o niższym potencjale będzie się roztwarzał
Heksacyjanian jest do określenia miejsc katoda anoda, czyli redukcja utlenianie. W miejsce gdzie jest utlenianie - anoda będzie niebieskie zabarwienie, a tam gdzie uwalnianie są elektrony w procesie depolaryzacji roztwór powinien zabarwić się na czerwono z tego co pamiętam