Wszystko
Najnowsze
Archiwum
konto usunięte via Android
- 1
@japecznikow: wyczyść paznokcie najpierw.
Spójrz na jednostkę stałej szybkości reakcji - podpowie Ci jakiego rzędu jest ta reakcja.
konto usunięte via Android
- 1
#japecznikontent #chemia #matura
Czy to nie jest przypadkiem tak ze ilosc substratow sie zmniejszy 3 krotnie wg reguly przekory?
Czy to nie jest przypadkiem tak ze ilosc substratow sie zmniejszy 3 krotnie wg reguly przekory?

źródło: comment_nhPvzAWuc7GNWIyb91PaQZEdWisOQtN8.jpg
Pobierz- 1
@japecznikow: Reguła przekory jest od przesuwania się położenia równowagi, nie jest stosowana w kinetyce.
Reagentów jest tyle samo, objętość jest mniejsza, więc stężenie jest większe. Z resztą dobrze zadanie policzone.
Reagentów jest tyle samo, objętość jest mniejsza, więc stężenie jest większe. Z resztą dobrze zadanie policzone.
Komentarz usunięty przez autora
konto usunięte via Android
- 1
#japecznikontent #chemia #matura
Czy to nie jest przypadkiem tak ze ilosc substratow sie zmniejszy 3 krotnie wg reguly przekory?
Czy to nie jest przypadkiem tak ze ilosc substratow sie zmniejszy 3 krotnie wg reguly przekory?

źródło: comment_EgRI1V5BtB1TVtbXPgWio0yy5zow0ICr.jpg
Pobierz- 2
@japecznikow: To nie jest reakcja odwracalna, nie ma tutaj stanu równowagi (strzałka reakcji w jedną stronę). Rozchodzi się o stężenie gazów - jeśli zmniejszysz objętość naczynia to zwiększysz ciśnienie i stężenie więc reakcja będzie zachodzić szybciej.
- 0
@neo_1995: aaa dobra dzieki
konto usunięte via Android
- 1
@japecznikow: Przecież z 2 moli etanolu nie otrzymasz 3 moli estru ;p
- 0
@Iperyt: upppsss no tak xD
konto usunięte via Android
- 1
- 2
@japecznikow: Palnąć w łeb autora zadania, który nie rozumie czym jest rząd reakcji i że w żadnym wypadku nie wynika on z wyrażenia na stałą równowagi, tylko trzeba go sprawdzić empirycznie.
- 1
@Iperyt: Ale jak popatrzysz do zbiorów zadań/podręczników z fizyki to tam są jeszcze lepsze jaja, bo potrafią wziąć z sufitu wykres do którego wykonania należało wsadzić szklankę wody z termometrem do lodówki i odczytać wyniki kilka razy w ciągu godziny, "Fizyka w szkole" lubiła swego czasu się pastwić nad takimi "danymi doświadczalnymi" kiedy recenzent wykazał więcej rzetelności niż autor podręcznika:)
#japecznikontent #chemia #matura
W regule przekory jak zmienia się stała równowagi? Ktoś wytłumaczy pls?
W regule przekory jak zmienia się stała równowagi? Ktoś wytłumaczy pls?
@japecznikow: Zmienia się jedynie ze zmianą temperatury i wraz ze wzrostem temperatury rośnie dla reakcji endotermicznych. Odwrotnie dla egzotermicznych.
@japecznikow: stała równowagi jest stała.
konto usunięte via Android
- 1
konto usunięte via Android
- 1
@japecznikow: No niestety. Poniżej bardzo dobrze zrobione, można się przyczepić jedynie o brak kółek w górnym indeksie xD
- 0
@Iperyt: znaczy te kółka chyba sie pisze kiedy entalpie definiuje sie w jednostce kJ/mol, a jak bez kółka to kJ (przynajmniej tak pisze w zadaniach)
#japecznikontent #matura #chemia #biologia
Uff wlasnie skonczylem bufory, zostało mi jeszcze termochemia, elektrochemia i organika, na szczęście tego się w miare przyjemnie uczy, szczegolnie że z organiki mam zajebioszcze notateczki, nie moge się doczekać aż to skończę i zaczne powtarzać cały materiał, no i wypadałoby już poważnie się zabrać za biologie, bo mimo że się coś tam uczyłem to zdecydowanie za mało, w tydzień
Uff wlasnie skonczylem bufory, zostało mi jeszcze termochemia, elektrochemia i organika, na szczęście tego się w miare przyjemnie uczy, szczegolnie że z organiki mam zajebioszcze notateczki, nie moge się doczekać aż to skończę i zaczne powtarzać cały materiał, no i wypadałoby już poważnie się zabrać za biologie, bo mimo że się coś tam uczyłem to zdecydowanie za mało, w tydzień
- 1
@japecznikow: pójdziesz na studia to materiał do matury będziesz opanowywał w kilka wieczorów ( ͡° ͜ʖ ͡°)
- 1
@Precypitat: lekarski>farmacja
konto usunięte via Android
- 1
#japecznikontent #matura #chemia
jakis sposob na obliczenie pierwiastka 3 stopa z 7,1 przy uzyciu maturalnego kalkulatora? xD
jakis sposob na obliczenie pierwiastka 3 stopa z 7,1 przy uzyciu maturalnego kalkulatora? xD

źródło: comment_M22ovWZcmKSXV5DCoj8fPktxm2l84Sw4.jpg
Pobierz@japecznikow: śmiesznego pazura masz
@japecznikow: Ir = s*(2s)^2 = 4s^3
konto usunięte via Android
- 1
#japecznikontent #chemia #matura
Moge sobie zapisywac tutaj dwie strzalki? Czy to tylko moge robic w reakcjach z woda?
Moge sobie zapisywac tutaj dwie strzalki? Czy to tylko moge robic w reakcjach z woda?

źródło: comment_wj4NKjYhbvp24Y8qhPswakGaLc3xvVH4.jpg
Pobierz@japecznikow: Możesz. Chociaż dla reakcji pierwszej wydaje się to być mniej oczywiste i intuicyjne. Radziłbym unikać ich w sytuacji gdy powstający produkt opuszcza środowisko reakcji, szczególnie gdy wydziela się gaz.
@japecznikow każda sól się w mniejszym lub mniejszym stopniu rozpuszcza (przechodzi spowrotem do postaci jonów) więc zasadniczo to nie będzie błąd
#japecznikontent #chemia #matura
Hydrolize NH4+ mam pisać tak: NH4+ + H2O ---> NH4OH + H+
Czy tak: NH4+ + H2O ---> NH3 (strzałka w góre) + H3O+
Czy może obydwie opcje są poprawne? Bo ja wole np. te pierwszą
Hydrolize NH4+ mam pisać tak: NH4+ + H2O ---> NH4OH + H+
Czy tak: NH4+ + H2O ---> NH3 (strzałka w góre) + H3O+
Czy może obydwie opcje są poprawne? Bo ja wole np. te pierwszą
@japecznikow: Po pierwsze nie pisz NH4OH tylko NH3*H2O. Po drugie, strzałka w górę oznacza, że produkt opuszcza środowisko reakcji więc jej też nie pisz. Po trzecie hydroliza jonu amonowego jest reakcją odwracalną, więc strzałki w obie strony.
no i czy nie jest przypadkiem tak że w tej reakcji amoniak opuszcza środowisko?
@japecznikow: Gdyby opuszczał środowisku reakcji, to po pewnym czasie zamiast roztworu soli miałbyś roztwór kwasu.
Człowiek chce pomóc, sam kiedyś uczyłem się do matury, więc wiem jak to jest czegoś nie wiedzieć, znajduję stronę z rozwiązaniem problemu, wysyłam a tu ani be ani me ani pocałuj mnie w dupę, żadnych dodatkowych pytań tylko takie coś (pic related), bo zwróciłem uwagę, że wyciąganie wniosków w zadaniach z chemii leży na poziomie gimnazjum. Jak widać żadnej próby samodzielnego rozwiązania zadania tylko potrzeba podania na tacy, eh ta dzisiejsza młodzież.
źródło: comment_i3bczSSE7jpQ03zTxwAcy7OWJTNdZ5Rw.jpg
Pobierz
konto usunięte via Android
- 3
#japecznikontent #chemia #matura
Czym wgl jest wykres zmiany przewodnictwa xD? Czy ktos mi to wytlumaczy? Nawet nie wiedzialem ze cos takiego moze sie pojawic w zbiorze maturalnym.
Czym wgl jest wykres zmiany przewodnictwa xD? Czy ktos mi to wytlumaczy? Nawet nie wiedzialem ze cos takiego moze sie pojawic w zbiorze maturalnym.
@japecznikow: A tak z ciekawości to na jaki kierunek się przymierzasz i gdzie?
- 0
@Iperyt: dobra czyli w przypadku pierwszego wykresu (rozpuszczalnej soli) powinienem narysować "V" w wykresie tak aby niedotykało osi X (w punkcie równoważnikowym wciąż są jony Me+ i X- które mogą przewodzić prąd), a w przypadku drugiego wykresu (powstaje osad) powinienem narysować "V" tak aby dotykał oś X (w punkcie równoważnikowym nie ma żadnych jonów mogących przewodzić prąd bo jony OH- i H+ łączą się w H2O, a jony Me+ i
konto usunięte via Android
- 2
#japecznikontent #chemia #matura jakiego indykatora uzyc i dlaczego akurat ten? (drugie zdjecie w komentarzu)
Odp to zielen bromokrzemowa
Odp to zielen bromokrzemowa

źródło: comment_j8HJbTLy0jg9HoOYBkB46OrQLX2nv4zd.jpg
Pobierz- 0
@japecznikow: Dokładną odpowiedź znajdziesz na pewno w podręcznikach do chemii analitycznej, po sieci krąży pdf Lipiec-Szmal (analiza dla studentów farmacji czy jakoś tak).
@Iperyt może będzie w stanie rozwiać wątpliwości.
@Iperyt może będzie w stanie rozwiać wątpliwości.
@japecznikow: Zakres pH pokazuje te wartości, dla których obie formy wskaźnika (protonowana i wolna zasada) występują w porównywalnych stężeniach. Dla zieleni bromokrezolowej dopiero powyżej pH 5.4 następuje zauważalna zmiana barwy - punkt końcowy miareczkowania (nie mylić z punktem równowagowym). Jak widać, dla krzywej C punkt pH 5.4 leży na "prostym" odcinku krzywej miareczkowania. Natomiast w przypadku krzywej D, przy wartości pH równej 5,4 pewna część kwasu nie została zobojętniona -
konto usunięte via Android
- 1
#japecznikontent #chemia #matura
Nie rozumiem jak zapisać podpunkt b (zdjęcie w komentarzu)
Łopatologicznie wiem że mocna zasada z mocnym kwasem w stechiometrycznych ilościach dadzą ph = 7
a mocna zasada ze słabym kwasem da ph > 7
a slaba zasada z mocnym kwasem da ph < 7
Ale jak zapisać wyjaśnienie które poprę zapisem jonowym to już nie ogarniam.
Nie rozumiem jak zapisać podpunkt b (zdjęcie w komentarzu)
Łopatologicznie wiem że mocna zasada z mocnym kwasem w stechiometrycznych ilościach dadzą ph = 7
a mocna zasada ze słabym kwasem da ph > 7
a slaba zasada z mocnym kwasem da ph < 7
Ale jak zapisać wyjaśnienie które poprę zapisem jonowym to już nie ogarniam.

źródło: comment_cpv04kGuUkAeFk0e0tqAHRy6YvUl7RJm.jpg
Pobierz@japecznikow: Nie sądzę. Lepiej napisać "W wyniku miareczkowania powstaje octan sodu - sól słabego kwasu i mocnej zasady, która ulega hydrolizie anionowej: [równanie reakcji]. Powstałe jony OH- odpowiadają za zasadowy odczyn roztworu.
- 0
@Iperyt: troche dziwactw mi dali w tym dziale, przeskocze chyba do hydrolizy a potem wróce do tego zadania, pewnie nie powinienem mieć wtedy problemów z tym
konto usunięte via Android
- 2
- 0
@Banderoza: ooo w takim razie
ZnSO4 jest kwasowy bo metal Zn ma słabe właściwości zasadowe(metaliczne) więc nie zobojętni SO4^2-
BaCl2 jest obojętny bo Ba ma mocne wlasciwosci zasadowe(metaliczne) więc da rade zobojętnić 2Cl^-
Czyli 1 to ZnSO4, a 3 to BaCl2
ZnSO4 jest kwasowy bo metal Zn ma słabe właściwości zasadowe(metaliczne) więc nie zobojętni SO4^2-
BaCl2 jest obojętny bo Ba ma mocne wlasciwosci zasadowe(metaliczne) więc da rade zobojętnić 2Cl^-
Czyli 1 to ZnSO4, a 3 to BaCl2
- 0
@Banderoza: cholera jak ja bym mial za zadanie zaprojektowac podobną tabelke i bym zapisal w tej ostatniej kolumnie ze to odczyn roztworu wyjsciowego zamiast odczyn roztworu wyjsciowego to by mi pewnie punkty zabrali :/
konto usunięte via Android
- 1
#japecznikontent #chemia #matura
Zmieszano jednakowe objetosci trzech 0,5 molowych wodnych roztworow:
BaI2, Pb(NO3)2, ZnSO4
i tutaj mnie zastanawia czy te sole z tresci zadania zadania (BaI2, Pb(NO3)2, ZnSO4) tez nie powinnienem zapisac w punkcie pierwszym? Chyba że musze tutaj brać pod uwage, że niektóre jony będą się łączyły w osady, a reszta jonów będzie się łączyła na zasadzie najsilniejsze metale z najsilniejszymi resztami kwasowymi (tak aby
Zmieszano jednakowe objetosci trzech 0,5 molowych wodnych roztworow:
BaI2, Pb(NO3)2, ZnSO4
i tutaj mnie zastanawia czy te sole z tresci zadania zadania (BaI2, Pb(NO3)2, ZnSO4) tez nie powinnienem zapisac w punkcie pierwszym? Chyba że musze tutaj brać pod uwage, że niektóre jony będą się łączyły w osady, a reszta jonów będzie się łączyła na zasadzie najsilniejsze metale z najsilniejszymi resztami kwasowymi (tak aby

źródło: comment_7R33V9PtJeVMdBRFW2SEzLgYd5cqKEaC.jpg
Pobierz- 0
Treść przeznaczona dla osób powyżej 18 roku życia...
konto usunięte via Android
- 2
O co chodzi z jonami nie biaracymi udzial w reakcji? Tu chodzi o te na+ cl- i ca2+? Nie ma o tym wzmianki w odpowiedziach #japecznikontent #chemia #matura

źródło: comment_A6g8SCyxyIGqBuKhTWUF4yEKcCQgbNrI.jpg
Pobierz@japecznikow: Tak, to są te, które "skreślasz", jak robisz zapis jonowy-skrócony.
- 0
@japecznikow: Jony nie biorące udziału w reakcji, to jony... nie biorące udziału w reakcji. Czyli musisz podkreślić te jony, które znajdują się po prawej i lewej stronie równania: Na+, Cl- i Ca2+. W zapisie skróconym reakcji byś je pominął.
edit. Ehh, przez 3h nikt nie odpowiada, ale gdy ja napiszę odpowiedź, to @Kotwpizamie ubiega mnie o 2 minuty...
edit. Ehh, przez 3h nikt nie odpowiada, ale gdy ja napiszę odpowiedź, to @Kotwpizamie ubiega mnie o 2 minuty...













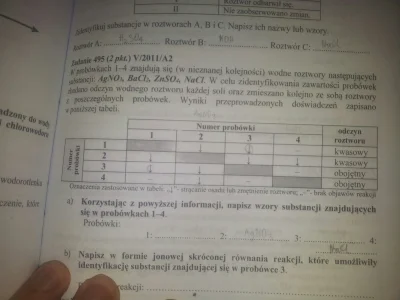


Jakis pomysl jak to zrobic?
źródło: comment_ol1nNCMU9I3LZ1PRLwK2vG48WBGbUSvZ.jpg
Pobierz(-) X | X(n+) || Y(n+) | Y (+)
A(-) X = X(n+) + n elektr
K(+) Y(n+) + n elektr = Y
Po lewej