#chemia #matura #japecznikontent
Cu + HNO3 (rozć) --> Cu(NO3)2 + NO + H2O
Żeby ta reakcja zaszła to musi być podgrzewana próbówka (T nad strzałką)?
PS tak wiem nie dałem współczynników
Cu + HNO3 (rozć) --> Cu(NO3)2 + NO + H2O
Żeby ta reakcja zaszła to musi być podgrzewana próbówka (T nad strzałką)?
PS tak wiem nie dałem współczynników






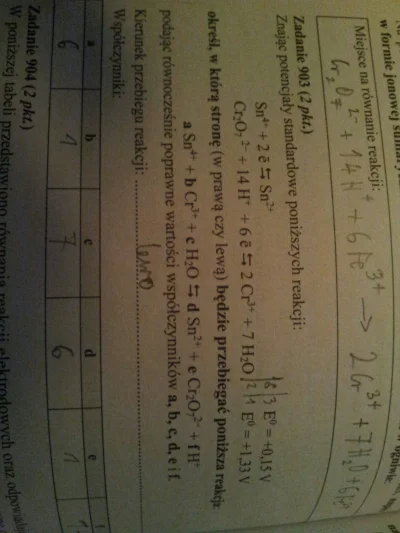








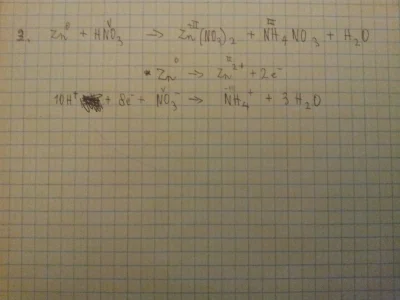

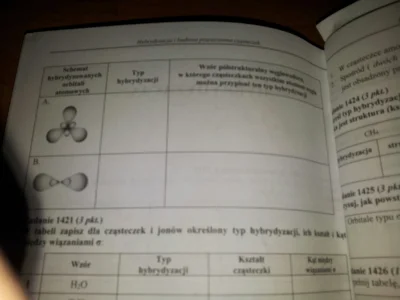

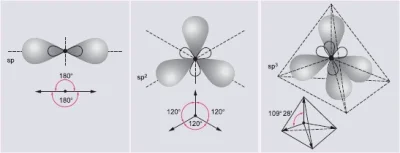

#chemia #matura #japecznikontent